Технология производства соляной кислоты и ее технико-экономическая оценка
Соляная кислота (хлороводородная кислота), по химическому составу отвечающая хлориду водорода находит широкое применение в ряде отраслей народного хозяйства.
В промышленности соляную кислоту получают следующими способами:
- сульфатным;
- синтетическим,
- из абгазов (побочных газов) ряда процессов.
Однако следует отметить, что первые два метода теряют свое промышленное значение.
Производство соляной кислоты (реактивной, полученной сульфатным способом, синтетической абгазной) заключается в получении HCI с последующей его абсорбции водой. В зависимости от способа отвода теплоты абсорбции, которая достигает 72,8 кДж/моль процессы разделяются на изотермические (при постоянной температуре), адиабатические (без теплообмена с окружающей средой) и комбинированные.
1. Сульфатные метод основан на взаимодействии хлорида натрия NaCl с концентрированной серной кислотой H2SO4 при 500-550*С. Реакционные газы отходящие от муфельных печей содержат 50-65% хлороводорода, а газы от реакторов с кипящим слоем до 5% HCI. В настоящее время предложено заменить серную кислоту на смесь SO2 и О2 с использованием в качестве катализатора Fe2O3 и проведением процесса при температуре 540*.
2. В основе прямого синтеза соляной кислоты лежит цепная реакция горения:
Р2-CI2+2HCI +184,7кДж (3.1)
Реакция инициируется светом, влагой, твердыми пористыми веществами (древесный уголь, пористая платина) и некоторыми минеральными веществами (кварц, глина). Синтез в камерах сжигания ведут с избытком в 5-10% Н2. Камеры выполнены из стали, графита, кварца, огнеупорного кирпича. Наиболее современным материалом, предотвращающий загрязнение продукта является графит, импрегнированный фенолоформальдегидными смолами. Для предотвращения взрывного характера горения реагенты смешивают непосредственно в факеле пламени горелки. В верхней зоне камер сжигания устанавливают теплообменники для охлаждения реакционных газов до 150-160*С. Мощность современных графитовых печей достигает 65т/сут (в пересчете на соляную кислоту содержащую 35% HCI). В случае дефицита водорода применяют различные модификации процесса. Например, пропускают смесь CI2 c водяным паром через слой пористого раскаленного угля:
CO+H2O+CI2=2HCI+CO2 (3.2)
Более 90% соляной кислоты в СНГ в настоящее время получают их абгазного хлороводорода HCI, образующегося при хлорировании и дегидрохлорировании органических соединений, пиролизе хлорорганических отходов, хлоридов металлов, получении калийных нехлорированных удобрений и др.
Абгазные газы содержат различные количества хлороводорода, инертные примеси (N2H2CH4), малорастворимые в воде органические вещества (хлорбензол, хлорметаны), водорастворимые вещества (уксусная кислота, хлораль), кислые примеси и воду.
При содержании инертных примесей менее 40%, является целесообразным применение изотермической абсорбции:
HCI в абгазных газах. Наиболее перспективными являются абсорберы, позволяющие извлекать из исходного абгаза от 65-85% HCI.
В промышленности для получения соляной кислоты наиболее широко применяют схемы адиабатической абсорбции. Абгазные газы вводят в нижнюю часть абсорбера, а воду (или разбавленную соляную кислоту – противотоком в верхнюю.
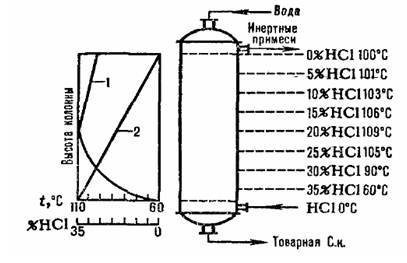
Соляная кислота нагревается до температуры кипения благодаря температуре растворения HCI. Зависимость изменения температуры абсорбции и концентрации HCI показана на рис. 3.1
 |
.
3.1Схема распределения температур (кривая 1) и концентрации (кривая 2) HCI при высоте адиаботического абсорбера
Температура абсорбции определяется температурой кипения кислоты соответствующей концентрации, максимальная температура кипения азеотропной смеси находится около 110*.
Типовая схема адиабатической абсорбции HCI из абгазов, образующихся при хлорировании, представлена на рисунке 4.2. Хлороводород поглощается в абсорбере 1, а остатки малорастворимых в воде органических веществ отделяют от воды после конденсации в аппарате 2, дочищают в хвостовой колонне 4 и сепараторах 3,5 и получают товарную соляную кислоту.
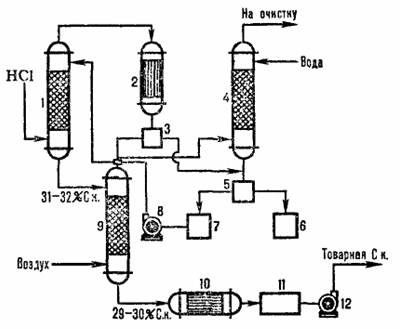
1 – абиабатический абсорбер; 2 – конденсатор; 3, 5 – сепараторы; 4 – хвостовая колонна; 6 – сборник органической фазы; сборник водной фазы; 8,12 – насосы; 9 – отдувочная колонна; 10- теплообменник, 11 – сборник товарной кислоты.
Рис.3.2Схема типовой адиабатический абсорбции соляной кислоты из абгазов
Получение соляной кислоты из абгазных газов с использованием комбинированной схемы абсорбции представлено в виде типовой схемы на рис.3.3.

